Wissenschaftliches Programm
Zentrale Forschungsidee. Die Arzneimitteltherapie hat bei vielen
malignen Tumoren auch in fortgeschrittenen Stadien große
Erfolge zu verzeichnen, bei allerdings hohen – und für
den einzelnen Patienten unvorhersehbaren – Risiken schwerer
Nebenwirkungen. Auch das Ansprechen auf die Therapie ist im Einzelfall
schwer vorherzusehen. Sowohl für die individuell schwer vorauszusagenden
Nebenwirkungen als auch für das Ansprechen auf die Therapie
dürfte die genetische Variabilität sowohl in den Tumorzellen
als auch in den nicht vom Tumor befallenen Zellen von wesentlicher
Bedeutung sein (Abb. 1).
Nach Abschluss des Human Genome Projekts ist die Erforschung der
genetischen Variabilität des menschlichen Genoms ein wesentliches
Forschungsgebiet der nächsten Jahrzehnte. Schwerpunkt wird
die Erforschung der funktionellen Bedeutung genetischer Variabilität
sein (functional genomics). Speziell im Bereich der onkologischen
Therapie richten sich die Erwartungen auf die rasche Anwendung
dieses Wissens, da es in der Krebstherapie im besonderen Maße
darauf ankommt, dass die Patienten von Beginn der Behandlung an
genau das richtige Medikament und genau die richtige Dosis bekommen.
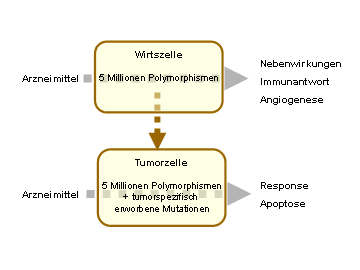
Abb. 1. Man schätzt die Zahl der erblichen Polymorphismen
im menschlichen Genom auf bis zu 5 Millionen. Polymorphismen sind
definiert als Varianten mit einer Häufigkeit > 1%. Diese
Varianten finden sich in den gesunden Körperzellen (Wirtszellen),
aber wurden natürlich auch an alle Tumorzellen „vererbt“.
Im Tumor finden sich darüber hinaus eine Reihe Tumor-spezifischer
Mutationen. In den Wirtszellen dürften die Varianten vor allem
für individuelle Unterschiede in den Nebenwirkungen und der
Immunantwort verantwortlich sein, in den Tumorzellen für den
therapeutischen Effekt zum Beispiel vermittelt über Unterschiede
in DNA-Reparatur und Apoptose. Der therapeutische Effekt wird darüber
hinaus wesentlich von Tumormutationen bestimmt. Es ist aber bekannt,
dass genetische Variabilität der Wirtszellen auch über
die maximal tolerierbare Dosis hinaus die Tumor-Response beeinflusst
(z.B. Immunmechanismen).
Das Konzept einer pharmakogenomischen Testung vor Zytostatikatherapie,
das bislang nur für einige wenige Zytostatika etabliert ist,
soll hier systematisch weiterentwickelt werden. Dabei untersuchen
die einzelnen beteiligten Arbeitsgruppen oft jeweils einen spezifischen
Tumor. Zugleich bearbeitet jede der Arbeitsgruppen ein spezifisches
Teilgebiet der Tumorbiologie und stellt diese spezifische Expertise
ebenso wie die speziellen Methoden den anderen Arbeitsgruppen und
hier insbesondere den Doktorand(inn)en zur Verfügung. Angeborene
Varianten der Wirtszellen sollen mit spezifisch messbaren funktionellen
Effekten in Verbindung gebracht werden.
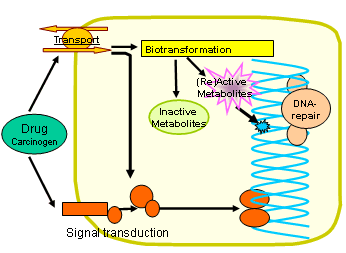
Abb. 2. Schematische
Darstellung ausgewählter möglicher Zusammenhänge
auf zellulärer Ebene, die im Graduiertenkolleg unter dem Gesichtspunkt
der genetischen Variabilität untersucht werden. Mehrere Arbeitsgruppen
untersuchen gemeinsam den Zytostatika-Transport über Zellmembranen,
die Zytostatika-Bioaktivierung und Biotransformation zu inaktiven
Metaboliten, die DNA-Reparaturprozesse unter Zytostatikatherapie,
sowie unterschiedliche Aspekte der Signaltransduktion in Bezug
auf Zellwachstumsregulation, Apoptose und Regulation der Angiogenese.
Die dargestellte Zelle soll je nach Zusammenhang sowohl eine Tumorzelle
als auch eine Wirtszelle repräsentieren.
Verfügung. Angeborene
Varianten der Wirtszellen sollen mit spezifisch messbaren funktionellen
Effekten in Verbindung gebracht werden.
Die Arbeitsgebiete, in denen die Bedeutung genetischer Variabilität
wesentlicher onkologischer Zusammenhänge (Abb. 2) untersucht
werden soll, sind insbesondere die folgenden:
•Nur wenn ein Medikament in ausreichenden
Mengen an die Tumorzellen gelangen kann, kann es wirken. Personen,
die Medikamente sehr schnell verstoffwechseln, werden Opfer der
mangelnden Wirkung der Medikament, Personen, die Medikamente nur
sehr langsam ausscheiden, können den Nebenwirkungen zum Opfer
fallen.
•Komplexe Krankheiten wie Tumoren können
nur durch die Anwendung moderner Formen tierexperimenteller Forschung
verstanden werden.
•Das Studium
der Signalvermittlungswege, deren Störung bei Tumoren und
deren Beeinflussung durch Medikamente bring uns um entscheidende
Schritte vorwärts.
Die medizinische Bedeutung der experimentellen Ergebnisse muss
anhand klinischer Endpunkte überprüft werden. Dazu stehen
große Kollektive gut charakterisierter Patienten aus klinischen
Therapiestudien zur Verfügung. Hieran soll schließlich überprüft
werden, inwieweit sich tatsächlich pharmakogenomische Daten
zu Polymorphismen oder Genexpressions-Signaturen in der Medizin
zur Therapieplanung eignen.
Forschungslandschaft und Forschungsbedingungen. Die Onkologie
und die Pharmakogenomik sind eingebettet in eine sehr aktive biomedizinische
Forschungslandschaft in Göttingen.
Hierdurch wird auf dem Gebiet der Krebsforschung ein breites, an
einem international hoch-kompetitiven
Forschungsprojekt orientiertes Ausbildungsangebot offeriert. Zwischen
den Betreuern des Kollegs gibt es enge Kooperationen, gemeinsam
untersuchte Patientengruppen, gemeinsame Gewebe- und DNA-Datenbanken,
sowie ausgewählte Zielmoleküle, die für mehrere
Gruppen gemeinsam von Interesse sind.
Interdisziplinäre Forschung. Ein zentrales gemeinsames Projekt
ist die Untersuchung pharmakogenomischer Prädiktoren für
Nebenwirkungen und Therapieerfolg bei malignen Lymphomen. Aber
auch weitere Tumorarten werden intensiv erforscht. Eine optimales
Dissertationsprojekt in unserem Graduiertenkolleg ist interdisziplinär
und Abteilungs-übergreifend unter Beteiligung von mehreren
teils klinisch, teils theoretisch ausgerichteten Abteilungen. Beispiele,
die das Konzept aber noch keineswegs erschöpfend beschreiben,
wären:
•
Pharmakogenomik des Arzneitransportes (Physiologie, Hämatologie/Onkologie,
Klinische Pharmakologie)
•
Pharmakogenomik der Signaltransduktion (Hämatologie/Onkologie,
Max-Planck-Institut, Immungenetik, Pädiatrie in Zusammenarbeit
mit den Abteilungen für Bioinformatik und Biostatistik)
•
Genomweite Expressionsanalysen als Methode zur Analyse individueller
Unterschiede in den Arzneimittelwirkungen (Hämatologie/Onkologie,
Klinische Pharmakologie, Pädiatrie, Entwicklungsgenetik in
Zusammenarbeit mit dem Transkriptomlabor)
Ausbildung der Wissenschaftler(innen). Ergänzend zu einer
intensiv betreuten Arbeit am Promotionsprojekt wird ein umfangreiches
Studienprogramm geboten.
•
Eine Blockveranstaltung – Summer School: Pharmacogenomics
in Oncology – vermittelt Einblicke in die einzelnen Labors
ebenso wie aktuelle Fakten aus Krebs- und Genomforschung. Diese
Blockveranstaltung als Kombination von Laborpraktikum und Abendseminaren
soll anschließend jährlich wiederholt werden.
•
Es soll eine kontinuierliche Qualitätskontrolle aller Unterrichtsveranstaltungen
aber auch der Leistungen der Kollegiat(inn)en gewährleistet
werden. Dazu dient die Vergabe von credit points für Teilnahme
und Leistungen im Rahmen aller Ausbildungsveranstaltungen, um so
zu einer transparenten und qualifizierten Bewertung der Kollegiat(inn)en
zu kommen. Zugleich vergeben die Kollegiat(inn)en Bewertungspunkte
für jede der besuchten Ausbildungsveranstaltungen.
•
Die gezielte Integration von Übungen zur Forschungskonzeption
und zur Erstellung von konkreten Forschungsanträgen.
•
Eine breite Ausrichtung von der molekular- und zellbiologischen
Arbeitstechnik, über fundierte Einblicke in klinische Forschung
bis zur betont konsequenten Anwendung von Prinzipien der Biostatistik,
Epidemiologie und bioinformatischen Datenmodellierung bei den Forschungsprojekten.
Kein Elfenbeinturm akademischer Forschung. International wird
die pharmakogenomische Forschung sowohl in akademischen Institutionen
als auch in der pharmazeutischen Industrie und in spezifisch auf
Pharmakogenetik ausgerichteten Biotechnologiefirmen betrieben.
Die Antragsteller verfügen über vielfältige Kontakte
sowohl zur pharmazeutischen Industrie, die Forschung im Bereich
der Pharmakogenomik durchführt, also auch zu entsprechenden
akademischen Forschungsinstitutionen im Ausland. Selbstverständlich
wird dies für die Ausbildung der Doktorand(inn)en genutzt
werden.
.